Axonale Modellierung
Entwicklung mathematischer Modelle, um den Zusammenhang zwischen der Mikrostruktur der weißes Substanz des Gehirns und axonalen Zeitverzögerungen zwischen verschiedenen Hirnregionen herzustellen.
Die weiße Substanz besteht aus axonalen Projektionen zwischen entfernten Hirnarealen, und Myelin, das die Signalübertragung beschleunigt. Obwohl die Signalübertragung schnell ist, trägt sie doch entscheidend zu Zeitverzögerungen bei, die kritisch für die kortikale Dynamik und die Synchronisation zwischen Hirnarealen sind. Zusätzlich zu traktographischen Methoden, erlauben moderne MRT Techniken die Mikrostruktur der weißen Materie auf nicht-invasive Weise detailliert zu erkunden. Das Wissen um diese Mikrostruktur kann genutzt werden, um mathematische Modelle, die die neuronale Aktivität auf der Ebene des gesamten Gehirns beschreiben, zu erweitern und zu verfeinern, indem man die Zeitverzögerungen basierend auf den mikrostrukturellen Eigenschaften in das Modell übernimmt. Dieses Projekt hat zum Ziel, den Zusammenhang zwischen der Geschwindigkeit axonaler Signalübertragung (und der daraus folgenden Zeitverzögerungen) und den strukturellen Parametern der weißen Substanz herzustellen, indem verschiedenartige mathematische Modelle herangezogen werden. Von besonderem Interesse sind die Sensitivität der Übertragungsgeschwindigkeiten in Bezug auf strukturelle und funktionale Parameter, aber auch der mögliche Einfluß extrazellulärer Potentiale, die durch neuronale Signale erzeugt werden.
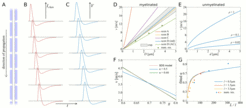
Im ersten Teil des Projekts entwickeln wir mathematische Modelle, die die Fortpflanzung von Aktionspotentialen in einzelnen Fasern beschreiben. Ein spezieller Fokus liegt hier auf sogenannten Spike-Diffuse-Spike Modellen, die die Erzeugung und Fortpflanzung von Aktionspotentialen mit Hilfe von Schwellwert-aktivierten Strömen beschreiben. In diesen Modellen wird die Ausbreitung eines Aktionspotentials entlang eines myelinisierten Axons (Abb. 1A) durch den zeitlichen Verlauf der Ionenströme bestimmt (Abb. 1B), den man experimentell bestimmen kann. Dieser und der Schwellwert für die Aktivierung dieser Ströme bestimmen die Geschwindigkeit und das zeitliche Profil eines Aktionspotentials (Abb. 1C). Solche Modelle lassen semi-analytische Lösungen zu, die es ermöglichen weite Parameterbereiche zu erkunden. Zu den mikrostrukturellen Parametern, die nicht-invasiv gemessen werden können, gehören die Faserdurchmesser und die sogenannte g-ratio, die das Verhältnis zwischen dem inneren Durchmesser (Axon) und dem äußeren Durchmesser (Axon + Myelin) eines myelinisierten Axons beschreibt. Unsere Modellierungsstudien bestätigen bereits bekannte Resultate in Bezug auf die Geschwindigkeitsabhängigkeit vom Axondurchmesser sowohl in myelinisierten als auch unmyelinisierten Axonen (Abb. 1D & Abb. 1E), zeigen aber auch auf, dass die Abhängigkeit von der g-ratio größer ist als bisher bekannt (Abb. 1F). Letztere wird stark durch das Verhältnis zwischen Interknotenlänge und Knotenlänge bestimmt (Abb. 1G).
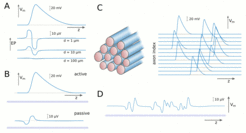
Der zweite Teil beschäftigt sich mit der Erzeugung von extrazellulären Potentialen durch Aktionspotentiale, und wie jene die Fortpflanzungsgeschwindigkeiten dieser beeinflussen. Die extrazellulären Potentiale können aus den Strömen, die beim Auftreten eines Aktionspotentials entlang des Axons fließen, berechnet werden. Gewöhnlich sind die extrazellulären Potentiale, die durch einzelne Aktionspotentiale erzeugt werden (Abb. 2A), und die daraus resultierenden Störungen des Ruhepotentials in benachbarten Axonen (Abb. 2B), relativ schwach (Größenordnung: 10 Mikrovolt). Wenn man eine Vielzahl von stark synchronisierten Aktionspotentialen (sogenannten spike volleys) betrachtet (Abb. 2C), können diese allerdings wesentlich größer sein (Abb. 2D). In makroskopischen Faserbündeln können die extrazellularen Potentiale mehrere Millivolt erreichen. Als Folge erfahren Axone eine bedeutende Modulierung des Schwellwertes für die Erzeugung von Aktionspotentialen, welches die Ausbreitungsgeschwindigkeit beeinflusst. Wir entwickeln Modelle, die diese Interaktion zwischen extrazellulären Potentialen und Ausbreitungsgeschwindigkeiten in makroskopischen Faserbündeln beschreiben.