Wie beeinflussen Sexualhormone Gehirn und Verhalten?
Forschungsbericht (importiert) 2016 - Max-Planck-Institut für Kognitions- und Neurowissenschaften
Depressionserkrankungen bei Frauen
Zahlreiche neuropsychiatrische Erkrankungsbilder sind auffallend unterschiedlich zwischen den Geschlechtern verteilt: So leiden beispielsweise Frauen doppelt so häufig unter Depressionen wie Männer. Die Depression zählt zu den häufigsten psychischen Krankheiten bei Frauen und ist mit einem enormen Leidensdruck für die Betroffenen sowie mit einer deutlichen ökonomischen Belastung für die Gesellschaft verbunden. Als eine mögliche Ursache für diese geschlechtsspezifischen Unterschiede bei Depressionen wird der Einfluss der Geschlechtshormone diskutiert.
In der fruchtbaren Lebensphase durchlebt das weibliche Gehirn zahlreiche hormonelle Übergänge, die mit einer erhöhten Anfälligkeit für Gemütsschwankungen einhergehen [1]: die Pubertät, eventuelle Schwangerschaften und Wochenbettzeiten sowie den Wechsel zur Menopause als Endpunkt des „reproduktiven Alters“. Diese hormonellen Übergangsphasen gehen mit deutlichen Östrogenveränderungen einher, zum Beispiel fällt der Östrogenspiegel nach einer Geburt um das 100- bis 1.000-Fache. In dieser Phase erleben die meisten Frauen auch kurzzeitige depressive Symptome im Rahmen des „Wochenbettblues“. Forscher des „EGG (Emotion & neuroimaGinG)-Labors“ am Max-Planck-Institut für Kognitions- und Neurowissenschaften fanden in Kooperation mit Forschern vom Centre of Addiction and Mental Health (CAMH) der University of Toronto parallel zum Abfall des Östrogenspiegels einen Anstieg von Monoaminoxidase-A: ein Enzym, das Monoamin-Neurotransmitter – in erster Linie das „Glückshormon“ Serotonin – abbaut [2]. Dieser vermehrte Monoaminverlust nach der Geburt scheint maßgeblich an der Entstehung einer Wochenbettdepression beteiligt zu sein.
Auch während der Schwankungen der Geschlechtshormone Östrogen und Progesteron im Verlauf des Menstruationszyklus erleben viele geschlechtsreife Frauen kurzzeitig Symptome wie Affektlabilität, Stimmungsschwankungen und Antriebslosigkeit [3]. Der Höhepunkt dieser Stimmungsveränderungen wird typischerweise zwei bis drei Tage vor dem Einsetzen der monatlichen Blutung angegeben. Darüber hinaus berichtet eine kleinere Gruppe von Frauen schwerwiegende depressive Symptome. Es handelt sich hierbei um das Krankheitsbild der prämenstruellen Dysphorie (PMDD) [4]. Betroffene Frauen haben auch ein erhöhtes Risiko für andere depressive Erkrankungen wie Wochenbettdepression und perimenopausale Depression. Allerdings gibt es keine Hinweise für typische Auffälligkeiten in den hormonellen Befunden von Frauen, die von PMDD betroffen sind. Da sich die Symptomatik relativ gut mit einer bestimmten Klasse von Antidepressiva, den Serotonin-Wiederaufnahmehemmern (SSRI = selective serotonin reuptake inhibitor), behandeln lässt, liegt die Vermutung nahe, dass das „Glückshormon“ Serotonin auf Schwankungen der Geschlechtshormone reagiert.
Das „Glückshormon“ Serotonin im Ungleichgewicht
Der Neurotransmitter Serotonin ist ein essenzieller Botenstoff, der die Übertragung von Informationen zwischen Nervenzellen im Gehirn steuert. Serotonin erfüllt eine Vielzahl von Funktionen im menschlichen Gehirn und ist besonders wichtig für Stimmung und zum Abfedern von Stress-Situationen. Serotonerge Ursprungskerngebiete liegen im Mittelhirn, genauer in den sogenannten Raphe-Kernen, und projizieren nahezu ins gesamte Großhirn (Abb. 1). Bei der Depression geht man von einem Ungleichgewicht im Serotoninhaushalt aus. Diese Annahme bildet den Grundstein für die „Monoamin-Hypothese“. Zur Behandlung dieses Ungleichgewichts werden Antidepressiva, beispielsweise die besagten SSRIs, eingesetzt. Diese Medikamente blockieren den Serotonintransporter und führen damit zu einem längeren Verbleib des Botenstoffs Serotonin zwischen den Nervenzellen. Obwohl diese Medikamente bereits seit knapp 40 Jahren wichtiger Bestandteil der Depressionsbehandlung sind, ist ihre genaue Wirkung auf die Vernetzung und die Kommunikation zwischen einzelnen Hirnregionen, die für die Stimmung wichtig sind, nicht genau verstanden.
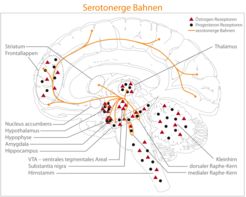
Abb. 1: Schematische Repräsentation der serotonergen Bahnen und der Verteilung von Östrogen- und Progesteron-Rezeptoren im menschlichen Gehirn. Die serotonergen Ursprungsbahnen liegen in den Raphe-Kernen und innervieren die Amygdala, den Hypothalamus, den Thalamus, das Striatum und den Hippocampus. Der mediale Raphe-Kern projiziert hauptsächlich zum Frontallappen und zum Hippocampus, während der dorsale Raphe-Kern überwiegend den Thalamus und das Striatum mit Nervenreizen versorgt.
Die Minerva-Forschungsgruppe „EGG (Emotion & neuroimaGinG)-Labor“ am Max-Planck-Institut für Kognitions- und Neurowissenschaften stellte sich diesbezüglich die Frage, inwieweit die Einmalgabe des SSRIs Escitalopram die Netzwerk-Kommunikation im Gehirn beeinflusst. In einer placebokontrollierten, doppelblinden Studie konnte mittels funktioneller Ruhe-Magnet-Resonanz-Tomographie (Ruhe-fMRT) erstmals ein beträchtlicher Abfall der funktionellen Netzwerkkonnektivität in den meisten kortikalen und subkortikalen Hirnregionen bereits drei Stunden nach der Einnahme von Escitalopram beschrieben werden (Abb. 2). Diese Ergebnisse sprechen für eine unmittelbare serotonerge Wirkung auf die globale Vernetzung des Gehirns. Diese neuronalen Signale stehen in Widerspruch zu klinischen Befunden, die typischerweise erst nach zwei bis drei Wochen eine stimmungsaufhellende Wirkung dieser Medikamente beschreiben. Diese Diskrepanz zwischen akuten neuronalen Netzwerkeffekten und der in der Praxis beschriebenen zeitlich verzögerten klinischen Therapieantwort ist Gegenstand gegenwärtiger Forschung.
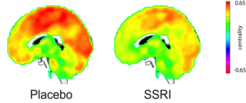
Abb. 2: Gegenüberstellung der durchschnittlichen zentralen Netzwerkverbindungen im gesamten Gehirn nach Placebo und SSRI. Sagittale Ansicht beider Behandlungsregime, unterlegt von einem T1-Standard-Gehirn: Placebo (links) und SSRI (Escitalopram 20 mg, rechts). Die orange Farbe entspricht einem höheren Maß an Konnektivität. Nach der Einnahme einer Einmaldosis des SSRIs Escitalopram kommt es zu einer globalen Abnahme der Konnektivität in den meisten kortikalen und subkortikalen Gehirnregionen.
Patienten mit akuter depressiver Symptomatik konzentrieren ihre Wahrnehmung und Bewertung oft hauptsächlich auf negative Informationen. Eine mögliche Erklärung für die zeitlich verzögerte antidepressive Wirkung der SSRIs auf Verhaltensebene könnte eine graduelle Abschwächung dieses Negativitäts-Bias darstellen: Jüngste Forschungsergebnisse deuten darauf hin, dass diese schrittweise Verringerung der negativen Verzerrung bereits relativ zeitnah nach der ersten Medikamenteneinnahme beginnt, jedoch nicht unmittelbar und im gleichen Ausmaß auch subjektiv vom Patienten wahrgenommen wird [5]. Bisher ist ungeklärt, wie dieser stimmungsaufhellende Effekt durch wechselnde kognitive Belastung beeinflusst wird.
Mittels einer weiteren Versuchsreihe wurde untersucht, inwieweit die gleichzeitige kognitive und emotionale Aufmerksamkeit durch die Einnahme eines serotonerg wirksamen Medikaments beeinflusst wird: Die Studienteilnehmer führten während der MRT-Aufnahme eine Aufgabe durch, bei der ein bestimmter Buchstabe bei gleichzeitiger Ablenkung durch emotionale Reize identifiziert werden musste. Es zeigte sich nach Medikamenteneinnahme eine deutlich herabregulierte Aktivierung im kortiko-limbischen Netzwerk, das maßgeblich an der Verarbeitung negativ besetzter emotionaler Reize und deren kognitiver Einbettung beteiligt ist. Diese Effekte werden bereits nach drei Stunden sichtbar.
Solche Experimente tragen wesentlich dazu bei, die neurokognitiven Mechanismen, die durch die serotonerge Signalverarbeitung beeinflusst werden, zu verstehen. Perspektivisch soll dieses Verständnis dafür genutzt werden, eine frühzeitige Einschätzung der antidepressiven Wirksamkeit für den individuellen Patienten zu ermöglichen. Ob die akute Wirksamkeit dieser Medikamente auf die kognitive Wahrnehmung und die gleichzeitige Verarbeitung von emotionalen Reizen bei Frauen und Männern unterschiedlich ist, soll in weiteren Experimenten erforscht werden. Es stellt sich die Frage, inwieweit die geschlechtsspezifischen Veränderungen in der emotionalen Wahrnehmung und Verarbeitung durch hormonelle Schwankungen, unter anderem während des Menstruationszyklus, moduliert werden.
Der Menstruationszyklus: Ein natürlicher experimenteller Rahmen
Um diese Wissenslücke zu schließen, nutzen Wissenschafter der Minerva-Forschungsgruppe „EGG (Emotion & neuroimaGinG)-Labor“ die physiologischen Spiegel der Sexualhormone im weiblichen Menstruationszylus als natürliche experimentelle Bedingungen. Zu verschiedenen Zeitpunkten des Menstruationszyklus wird der Einfluss von Östrogen und Progesteron auf Gehirnstruktur und die Vernetzung von Hirnregionen untersucht. Dabei konnte Pionierarbeit geleistet werden: In einer longitudinalen Versuchsreihe wurden insgesamt 32 MRT-Aufnahmen der strukturellen und funktionellen Netzwerke einer gesunden Studienteilnehmerin gemacht. Es entstand sozusagen ein zeitlich geordneter individueller Gehirnatlas über insgesamt vier Menstruationszyklen. Darüber hinaus wurden bei jeder dieser Untersuchungen auch Blutproben entnommen, um die zyklusspezifische Konzentration der Geschlechtshormone Östrogen und Progesteron exakt bestimmen und in Zusammenhang mit den Daten aus der Netzwerkanalyse darzustellen zu können.
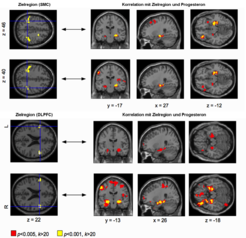
Bei der Auswertung der erhobenen Daten zeigten sich sowohl geschlechtshormonabhängige Veränderungen in der funktionellen Konnektivität als auch in der grauen und weißen Hirnstruktur im Verlauf des Menstruationszyklus. So fanden die Wissenschaftler einen Zusammenhang zwischen dem Geschlechtshormon Progesteron und der funktionellen Konnektivität zwischen dem sensomotorischen Kortex (SMC, Abb. 3 obere Zeile) mit dem Hippocampus und zwischen dem dorso-lateralen präfrontalen Kortex (DLPFC, Abb. 3, untere Zeile) und dem Hippocampus [6]. Diese Befunde geben erste Hinweise, dass die schwankenden Geschlechtshormonspiegel über den Menstruationszyklus die funktionellen Netzwerkverbindungen im Gehirn einer gesunden Frau verändern.
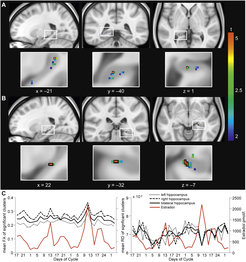
Dabei galt das Interesse besonders einer Hirnregion: dem Hippocampus, einem Areal mit einer zentralen Rolle für Gedächtnis, Emotion und Stimmung. Die progesteronmodulierte Konnektivitätsveränderung von dieser Hirnregion mit dem bilateralen präfrontalen und sensomotorischen Kortex könnte auf eine Beeinflussung der Emotionsregulation [7] und der Schmerzmodulation [8] durch die physiologischen Veränderungen der Geschlechtshormone während bestimmter Phasen des Menstruationszyklus hinweisen. Darüber hinaus lässt die Auswertung der anatomischen Hirndaten einen beachtlichen Grad an Neuroplastizität im Hippocampus vermuten. So zeigte sich sowohl für die weiße als auch für die graue Hirnsubstanz des Hippocampus ein positiver Zusammenhang mit dem Geschlechtshormon Östrogen. Die Wissenschaftler fanden eine Erhöhung der fraktionellen Anisotropie (FA, Marker für die Gerichtetheit von Wasserdiffusion in der weißen Hirnsubstanz [9]) mit hohen Östrogenwerten im bilateralen Hippocampus [10]. Dieser Effekt konnte mit einer Verringerung der radialen Diffusivität (RD, Wasserdiffusion senkrecht zur Hauptrichtung, einem Marker für Myelin [9]) verknüpft werden (Abb. 4). Zusammengefasst zeigen diese Ergebnisse, dass sich die Netzwerkkonnektivität des Hippocampus zu Arealen der Hirnrinde mit ansteigenden Progesteronwerten vor dem Einsetzen der Monatsblutung verändert; und dass parallel zum ansteigenden Östrogenspiegel bis zum Eisprung auch das Volumen des Hippocampus – sowohl in der grauen als auch in der weißen Hirnsubstanz – zunimmt. Ob und in welchem Ausmaß sich diese hormonabhängigen funktionellen und strukturellen Veränderungen im Hippocampus auf die individuelle Stimmungslage auswirken, soll in einem Folgeprojekt erforscht werden.
In dieser aktuellen Studie des „EGG (Emotion & neuroimaGinG)-Labors“ werden die strukturellen und funktionellen Veränderungen in Hirnregionen, die für die Kontrolle und die Verarbeitung von Emotionen wichtig sind, bei Frauen mit prämenstrueller Dysphorie untersucht. Insgesamt werden 30 gesunde Frauen und 30 Frauen mit PMDD mit Hilfe von MRT und Positronen-Emissions-Tomographie (PET) kurz nach dem Eisprung und vor dem Einsetzen der Blutung untersucht. Die PET-Messung dient der Darstellung und Quantifizierung der Übertragung von Serotonin im Gehirn in Abhängigkeit von den hormonellen Schwankungen über den Menstruationszyklus. Die in diesem Projekt erworbenen Erkenntnisse sollen helfen, Möglichkeiten der individuellen Therapieanpassung beziehungsweise die Optimierung über den optimalen Zeitpunkt einer pharmakologischen Therapieentscheidung zum Beispiel mit SSRIs bei Stimmungsveränderungen zu entwickeln.
Literaturhinweise
Frontiers in Neuroscience 9, 37 (2015)
Post Reproductive Health 18 (2), 48–51 (2012)
Current Psychiatry Reports 17, 87 (2015)
Frontiers in Neuroscience 9, 44 (2015)
Biological Psychiatry 53 (6), 502–510 (2003)
Pain 81 (3), 225–235 (1999)
Neurotherapeutics 4 (3), 316–329 (2007)
Scientific Reports 6, Article number: 32833 (2016)



